成都一类医疗器械备案注册申报时间(成都一类医疗器械备案注册申报时间是多久)
- 公司注册
- 2023-01-30
- 40
1、一自2022年5月1日起,本市企业接受其他省自治区直辖市医疗器械注册人委托生产第二类第三类医疗器械的,应向我局医疗器械生产监督管理处提出书面说明材料,我局将协商注册人所在地省自治区直辖市药品监督管理局。
2、关于医疗器械经营许可的介绍 第一类医疗器械的管理不需要备案或营业执照根据医疗器械管理监督管理办法的规定,按照医疗器械风险程度对医疗器械管理进行分类操作一类医疗器械不需要备案和许可经营二类医疗器械实行备案管理。
3、境内第二类医疗器械由省自治区直辖市食品药品监督管理部门审查,批准后发给医疗器械注册证境内第三类医疗器械由国家食品药品监督管理总局审查,批准后发给医疗器械注册证进口第一类医疗器械备案,备案人向国家食品药品监督。
4、首先要有quot医疗器械生产许可证quot,营业执照,医疗器械注册证指的是某一个产品的注册证一类的产品到市局申请,二类的产品到省局申请,三类的产品到国家局申请你产品的类型不同申请的条件不同可以上一下你们当地的食品药品监督。
5、境内第二类医疗器械由省自治区直辖市药品监督管理部门审查,批准后发给医疗器械注册证境内第三类医疗器械由国家药品监督管理局审查,批准后发给医疗器械注册证进口第一类医疗器械备案,备案人向国家药品监督管理局提交备案。

6、医疗器械经营企业资质有效期为5年,医疗器械的分类第一类是指,通过常规管理足以保证其安全性有效性的医疗器械不需要申请备案和资质 第二类是指,对其安全性有效性应当加以控制的医疗器械必须向有关部门申请本案。
7、境内第三类医疗器械由国家食品药品监督管理总局审查,批准后发给医疗器械注册证进口第一类医疗器械备案,备案人向国家食品药品监督管理总局提交备案资料进口第二类第三类医疗器械由国家食品药品监督管理总局审查,批准后发给医疗。
8、第四条医疗器械注册与备案应当遵循公开公平公正的原则第五条第一类医疗器械实行备案管理第二类第三类医疗器械实行注册管理境内第一类医疗器械备案,备案人向设区的市级食品药品监督管理部门提交备案资料境内第二类。
9、法规依据食品药品监督管理总局令第4号医疗器械注册管理办法具体需要提交的资料进对应省的政务网药品监督管理局,搜索“境内第二类医疗器械注册”,附湖北省参考如下友情提示具体涉及的方面比较广,比如质量管理体系。
10、您应该问的是三类医疗器械产品的注册要求,如果是生产企业您可以参照医疗器械监督管理条例 医疗器械生产部分下面是产品注册要求第十三条 第一类医疗器械实行产品备案管理,第二类第三类医疗器械实行产品注册管理医疗器械注册人备案人应。
11、法律法规医疗器械监督管理条例第十四条 第一类医疗器械产品备案和申请第二类第三类医疗器械产品注册,应当提交下列资料一产品风险分析资料二产品技术要求三产品检验报告四临床评价资料。
12、为做好第一类医疗器械备案工作,根据医疗器械监督管理条例国务院令第739号医疗器械注册与备案管理办法国家市场监督管理总局令第47号体外诊断试剂注册与备案管理办法国家市场监督管理总局令第48号,现就第。
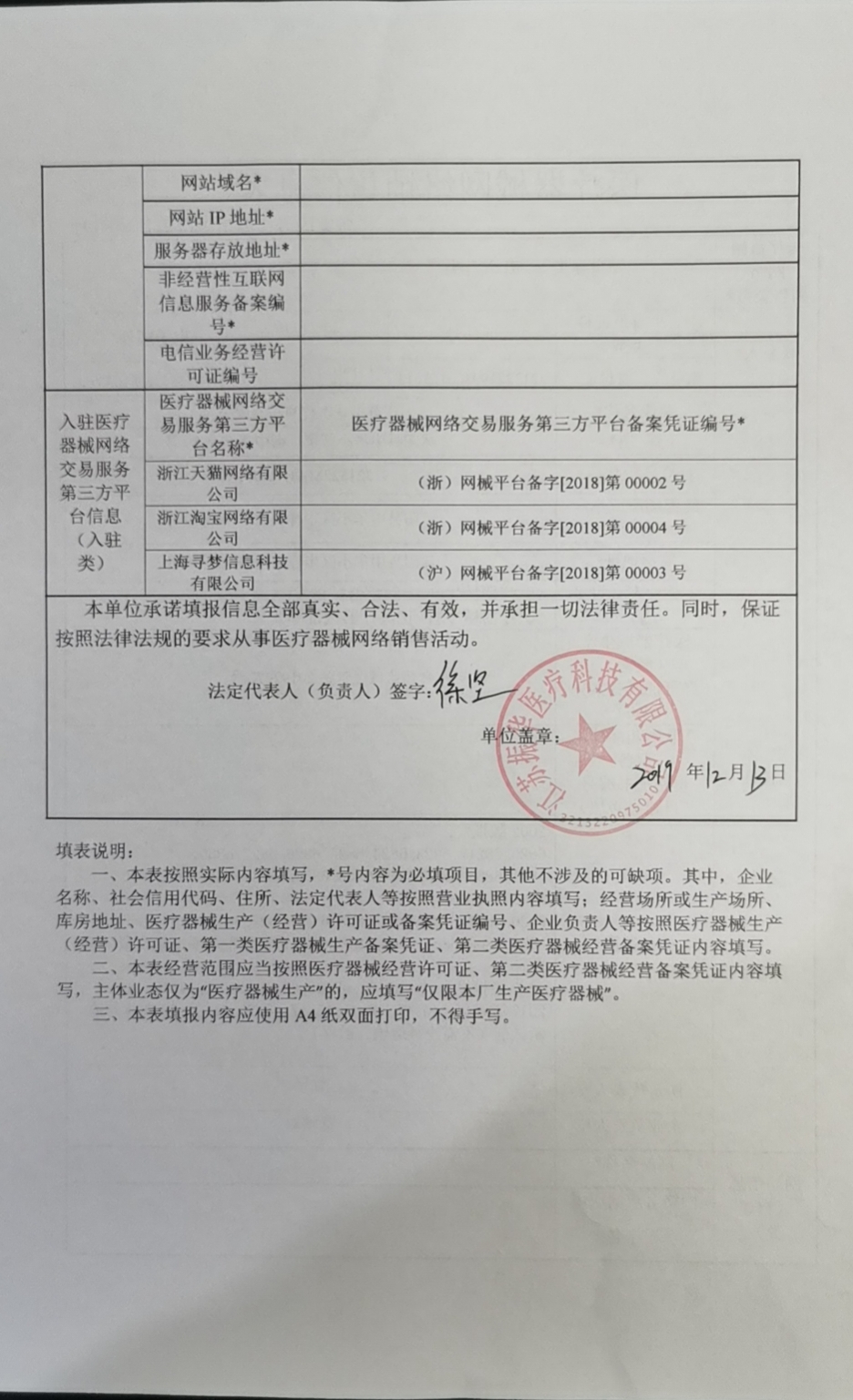
13、Par2申请第一类医疗器械经营企业备案程序和材料要求经营第一类医疗器械的企业,必须办理备案盖章手续备案程序和申报材料一经营包括兼营企业提出申请,填写医疗器械经营企业备案表一式3份复印件无效,由法人代表。
14、申请医疗器械经营许可证的条件首先,要具备医疗器械相关的技术人员和管理人员,大家都知道医药产品关系到人体生命财产安全的特殊产品,储存销售和管理医疗器械没有医学相关的技术人员是不行的,如果没有专业人员管理和销售这样。
15、新修订的条例进一步简化和下放了医疗器械生产经营审批,按照医疗器械风险程度,对生产经营活动实施分类管理将第一类医疗器械生产由向省局备案修改为向地市局备案将第一类医疗器械经营由原先备案管理改为不需备案直接经营第二类第三。
本文由投稿人小点于2023-01-30发表在成都创业号,如有疑问,请联系我们。
本文链接:https://www.liuninggang.cn/article/9402.html



